2020年9月 第2页
-
美国FDA认证更新医疗器械生物相容性ISO 10993最终指南
2019年1月14日,FDA宣布承认(部分)国际标准化组织10993-1:2018年医疗器械生物评估。第1部分:风险管理过程中的评估和测试。美国食品药品监督管理局的医疗器械监管机构已就制造商应如何利用ISO 10993标准对医疗器械进行生物学评估澄清了指南。 更新后的指南取代了该机构于2016年完成的指南,该指南强调了生物评估以及无菌和非无菌医疗器械上市前应用的风险管理考虑因素,包括510(k)上市前通知,上市前批准(PMA)和De Novo要求指定。该指南专门针对ISO 1...
-
如何遵守FDA认证洗手液法规避免产品召回
在本文中,您将了解如何避免FDA认证召回洗手液,并遵守FDA认证洗手液法规,本文将对制造商和将洗手液进口到美国的公司有所帮助。即使含有OTC成分(酒精和苯扎氯铵)的洗手液不需要FDA的事先批准,您也必须遵守FDA的某些要求。除了一般要求,例如注册和上市外,产品还应符合FDA的质量参数。FDA不要求公司提交任何有关手部消毒的测试报告。但是,FDA可能会对您的产品进行测试,以确认是否存在杂质和残留溶剂。如果发现任何杂质超过可接受水平,则FDA应采取强制措施。假设FDA认证测试的结果确认了甲醇等杂质;FDA认证将要求公司...
-
FDA认证注册更新时间表–何时续期更新FDA注册?
通常,FDA认证注册续签时间表是每年的10月1日至12月31日。但是,年度注册要求可能会因产品类别存在差异。FDA注册续签要求摘要:食品设施FDA注册更新时间表: 在10月1 日至12月31 日之间,食品设施必须每两年进行一次注册。例如,食品设施必须在2020年,2022年,2024年等进行续期注册。未及时续签您的注册可能会导致食品工厂注册被取消。如果在12月31日晚上11:59之前不续签食品加工厂注册,则该注册被视为已过期,将从您的帐户中删除。 FDA已简化了自该...
-
FDA医疗设备510(k)与CE认证标记Pt之间的差别
北美医疗器械公司的监管策略通常是明确定义的-食品药品管理局(FDA)制定的《食品,药品和化妆品法》第510(k)节是首选方法。但是,在某些情况下,首先在欧洲发行带有欧盟委员会(CE)标志的产品可能是有益的(例如,使用新颖的设备),或者只是希望在欧洲扩展和发行只是时间问题。尽管这是一个复杂的领域,但本文试图强调医疗器械510(k)和CE标记之间的5个异同点,以帮助不熟悉CE标记的人员有效地优先进行监管工作。本周,我将介绍术语,设备风险分类和流程。510(k)是进入美国市场的首...
-
FDA认证对医疗器械制造商的11部分的4个关键要求?
FDA认证医疗器械 21 CFR第11部分的第一段似乎非常简单明了,它说:“本部分的法规规定了标准,该机构认为电子记录,电子签名和对电子记录执行的手写签名是可靠,可靠的,并且通常等效于纸质记录和在纸上执行的手写签名。 ”医疗设备公司的第11部分最重要的4个合规性要求: 第11部分适用于各种各样的记录,包括测试协议,工作说明,生产记录,设计图纸,规格,上市前提交的文件等等。这些记录不仅是文本文档,还包括图像和视频。需要特别注意的是,FDA...
-
了解ISO13485:2016和美国FDA认证QSR中重要的义务
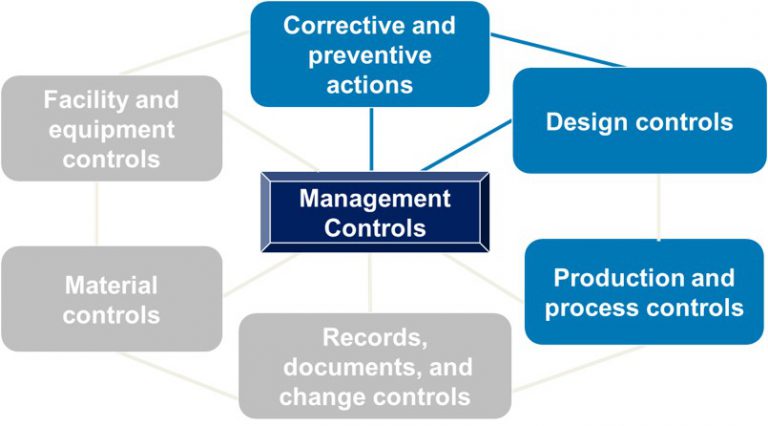
ISO标准和FDA认证法规涵盖的五个主题在本文中,我们无法涵盖ISO标准和21 CFR Part 820法规的所有方面,因此我们将重点关注五个关键领域:文件控制管理责任资源管理产品实现测量分析与改进1、文件控制如果没有可靠的文档控制, QMS将无法运行。如下所示,第4.2节和ISO 13485:2016的其他特定节概述了您的义务,并且FDA认证 QSR的各个子部分也都有规定。您必须维护几个重要文档–这只是部分列表:质量手册(ISO 13485:2016第4.2.2节)–提供有关QMS的总体指南,并定义关键信息,例如...
-
FDA认证QSIT:了解医疗器械QMS检查期间会发生什么
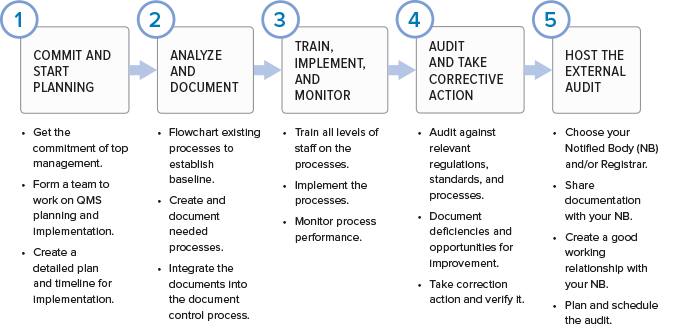
与大多数其他国家/地区的监管机构不同,美国食品药品监督管理局(FDA认证)依靠随机检查来保持医疗器械制造商的诚实。随时可能进行随机审核,这意味着制造商必须始终遵守FDA认证质量体系法规(QSR)。 每年都有太多的医疗器械制造商需要FDA认证进行检查,因此FDA认证根据制造商及其设备带来的风险来优先安排有限的检查人员。一些公司比其他公司更受关注。通常,II级和III级制造商可以期望每两年进行一次FDA认证访问。基于风险的方法意味着拥有新的或现有的III类设备的公司是最高优先级,...
-
符合美国FDA认证和EU要求的质量管理体系的关键组件
质量管理过程中的关键参与者 医疗器械公司您需要实施QMS并遵守FDA 21 CFR Part 820和/或ISO 13485:2016,正如我们之前提到的,在世界上大多数地区并不需要ISO 13485,但在许多国家中,ISO 13485无疑是满足QMS要求的“事实”手段。让我们从美国开始,谈谈在维护,审核和认证质量体系中发挥作用的实体。美国FDA认证和CDRH 美国食品药品监督管理局(FDA)内部是设备与放射卫生中心。该部门通常称为CD...
-
向FDA认证提交510(k)申请后的期望
FDA认证没有发布510(k)应用程序的特定模板,但他们希望您将其组织为20个特定部分。第14-20节可能不适用,具体取决于您的设备。尽管没有具体模板可循,但FDA认证确实在此处对每个部分的预期内容进行了全面的概述–您应首先阅读此页,因为它包含指向各个部分的许多其他指导文件的链接。510(k)申请的细节:1、医疗设备用户费用封面页(FDA认证 3601表格)2、CDRH上市前审查提交封面3、510(k)求职信4、使用说明声明5、510(k)摘要或510(k)声明6、真实准确...
-
FDA认证510(k)流程:为成功提交和更快批准奠定基础
如果您从未准备过医疗器械FDA上市前通知(通常称为510(k)提交),那么弄清楚从哪里开始可能会令人生畏。FDA认证网站提供了大量信息,在本文中,我们将提供有关如何进行FDA 510(k)批准程序的入门知识,解释该程序如何工作,并更多地讨论谓词设备研究和确定正确的产品代码。医疗器械FDA认证上市前通知流程的基本步骤:1、确认您的医疗设备的分类以及它是否属于510(k)途径。2、使用FDA网站,为您的设备标识适当的三个字母的产品代码和法规编号。3、在FDA数据库上进行研究,并选择要比较的谓词。4、在FDA网站上搜索适...
-
FDA认证与标准ISO 10993-1生物相容性评估风险管理
美国食品药品监督管理局(FDA认证)已发布了有关使用国际标准ISO 10993-1“医疗器械的生物学评估-第1部分:风险管理过程中的评估和测试”的详细指南。本文档旨在为与医疗设备相关的所有参与方提供有关应采用上述标准的方式的其他说明和建议。本FDA认证指南替代了2016年6月早些时候发布的先前版本。值得一提的是,由于其法律性质,该文件并未确立当事方应遵循的任何义务,而是描述了可能的方式。因此,能机构允许我们选择要使用的特定方法,前提是该方法符合适用法规中规定的一般要求。 FDA监管背景: &n...
-
FDA认证510(k)豁免设备的清单:您需要了解的知识
2017年3月14日,FDA认证正式发布公告,提议使数百种II类医疗设备免于需要510(k)提交的上市前通知要求。请注意,医疗设备的特定适应症也有一些例外情况。所有设备仍将需要满足其他FDA认证要求,例如21 CFR 820质量体系要求。 我们认为这种转变使FDA认证可以将其有限的资源集中在510(k)上市前通知途径中的高风险产品上,以及收到的510(k)和从头提交的数量越来越多。FDA认证还评论说,此更改将消除准备510(k)文件,支付用户费以及进行510(k)审查的需要,...
-
FDA认证:批准PMA年度报告,法规21 CFR 814.82
美国负责医疗器械监管的机构食品药品监督管理局(FDA认证)已发布了一份指导文件,专门针对已批准的上市前批准申请(PMA)的年度报告。 根据PMA批准令,根据《联邦食品,药品和化妆品(FD&C)法案》获得上市前批准的医疗设备也必须遵守报告要求。本FDA认证指南旨在为制造商和参与手术的其他方提供医疗器械。该文件特别概述了负责医疗器械的实体应根据适用的报告要求向监管机构提交的信息,包括要确保的详细程度,机构在审查年度报告时所采用的方法。该指南描述了年度报告的编写方式,以确保所提供信...
-
FDA认证对药品和医疗器械上市前后要求
医疗器械FDA认证上市前1.产品分类医疗器械按法规进行分类,即详细说明包含在联邦法规(21 CFR 862-892)中,并对每种器械列出了各种分类和要求。分为三类:第一类是风险最低的设备,第三类是风险最高的设备。分类法规还将说明该设备是否符合《良好生产规范》(GMP)的要求:大多数1类设备是免税的,大多数2类或3类设备都应受其管制。此外,所有医疗设备都必须与FDA一起列出:大多数2类设备均需遵循上市前通知510(k)程序,而大多数3类设备均需遵循上市前批准(PMA)流程。2.机构注册和产品清单“生产,制备,传播,配...
-
美国FDA认证自愿性共识标准:符合性声明的使用
美国食品和药物管理局(FDA认证)是医疗器械领域的监管机构,允许制造商在准备和评估医疗器械上市前申报时使用国家和国际自愿性共识标准。 为了帮助医疗器械制造商使用共识标准,FDA认证已发布了适当的指南,描述了在申请市场许可时参考自愿共识标准时要考虑的最重要方面。同时,必须指出的是,由于其法律性质,FDA认证指南并未规定制造商应遵循的任何强制性要求,而只是提供建议,允许使用替代方法来证明该方法符合适用要求。 FDA认证指南的范围涵盖FDA认证公认共识标准数据...