FDA认证资讯
-
一文读懂原料药DMF备案:API出口的“身份证”与“通行证”
在全球化制药产业链中,原料药(Active Pharmaceutical Ingredient, API)是制成制剂(如片剂、胶囊、注射液)的活性成分,是药品发挥药理作用的基石。然而,原料药生产商如何向全球各地的监管机构证明其产品的质量、安全性和有效性呢?答案的核心就是DMF备案。本文将为您彻底说清楚:什么是DMF,为什么需要它,它的类型、核心内容、备案流程以及常见误区。一、什么是DMF备案?—— 原料药的“技术身份证”DMF,全称为 Drug Master File,中文常译为“药物主文件”。它并不是一个“行政许...
-
蔬菜罐头FDA认证常见问题及解决方案
蔬菜罐头FDA认证过程中,企业经常会遇到各种技术性和管理性问题。本文系统梳理了常见问题及其解决方案,帮助企业顺利通过认证。 一、蔬菜罐头FDA认证生产工艺备案问题 1. 热加工工艺备案被拒- 问题表现: - 热穿透测试数据不充分 - 杀菌公式科学性不足 - 温度分布不均匀- 解决方案: - 聘请专业机构进行热分布测试 - 采用数据记录仪记录全程温度数据 - 确保杀菌锅热分布均匀性≤1℃ ...
-
果酱出口美国如何办理FDA认证?
果酱作为食品产品出口美国,必须完成FDA(美国食品药品监督管理局)认证注册。本文将详细解析认证要求、办理流程和关键注意事项,帮助企业顺利进入美国市场。 一、果酱FDA认证基本要求 1. 法规依据- 联邦食品、药品和化妆品法案(FD&C Act)- 21 CFR Part 110:现行良好操作规范(cGMP)- 食品安全现代化法案(FSMA)七项配套法规- 食品标签法规:21 CFR Part 101 2. 产品分类- 酸化食品:通过添加酸剂使pH≤4....
-
果酱出口美国办理FDA认证要求和流程
果酱作为食品产品出口美国,必须符合美国食品药品监督管理局(FDA)的相关法规要求。本文将详细解析FDA认证的具体要求和办理流程,帮助企业顺利完成产品准入。 一、果酱FDA监管框架 1. 法规依据- 联邦食品、药品和化妆品法案(FD&C Act)- 21 CFR Part 110:食品生产、包装、储存的现行良好操作规范- 食品安全现代化法案(FSMA)相关要求- 食品标签法规:21 CFR Part 101 2. 产品分类- 低酸罐头食品:pH值>4.6...
-
吸奶器办理FDA认证的要求和流程
吸奶器作为II类医疗器械,在美国市场销售必须通过FDA认证。本文将详细解析认证的具体要求、办理流程和关键注意事项,帮助企业顺利完成认证。 一、吸奶器FDA认证基本要求 1. 产品分类- II类医疗器械:产品代码FMF- 510(k)通道:需要提交上市前通知- 特殊控制:必须满足性能标准要求 2. 适用标准- 21 CFR 884.5380:吸奶器设备法规要求- IEC 60601-1:医用电气设备安全标准- ISO 10993:生物相容性评价标准 ...
-
吸奶器FDA认证必备测试项目与标准指南
吸奶器作为II类医疗器械,其FDA认证过程需要完成一系列严格的测试项目。本文将详细解析必备的测试要求、适用标准及技术规范,为企业提供完整的认证准备指南。 一、吸奶器FDA认证产品分类与监管要求 1. 医疗器械分类- II类医疗器械:产品代码FMF- 510(k)准入途径:需要证明与已上市产品的实质性等同- 特殊控制要求:必须满足性能标准和质量体系规范 2. 适用标准体系- 电气安全标准:IEC 60601-1(医用电气设备通用要求)- 专用标准:IEC 606...
-
如何顺利通过蔬菜罐头FDA认证?
蔬菜罐头FDA认证是产品进入美国市场的强制性要求。本文将为您详细解析认证流程、技术要点和合规策略,帮助企业高效完成认证。 一、蔬菜罐头FDA认证基本要求 1. 法规依据- 联邦食品、药品和化妆品法案(FD&C Act)- 21 CFR Part 108:紧急许可控制规定- 21 CFR Part 113:低酸罐头食品法规- 21 CFR Part 114:酸化食品法规 2. 产品分类- 低酸罐头食品:pH值>4.6,水活性>0.85- 酸化食品:通过添...
-
医用清洗器FDA认证技术文件准备清单
医用清洗器FDA认证技术文件是证明产品安全有效的重要依据。完整准确的技术文件不仅能加快审核进度,更是通过认证的关键保障。本文将提供详细的技术文件准备清单和要点说明。 一、医用清洗器FDA认证技术文件基本要求 1. 文件结构要求- 完整性与准确性:所有数据必须真实可靠- 可追溯性:数据来源和修改记录清晰可查- 格式规范:采用FDA接受的格式和标准- 语言要求:使用英文撰写,专业术语准确 2. 文件组织方式- 分级管理:按文件类型和重要性分级管理- 版本控制:实施...
-
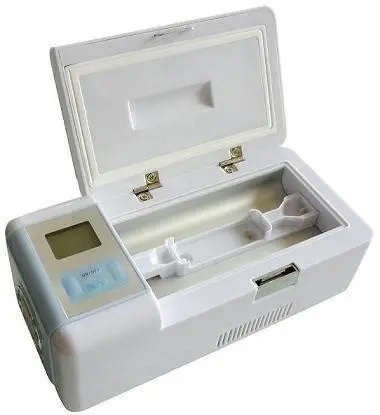
医用冷藏箱FDA认证流程与时间规划指南
医用冷藏箱FDA认证是产品进入美国市场的强制性要求。本文将详细解析认证流程、关键步骤和时间规划,帮助企业高效完成认证准备。 一、医用冷藏箱FDA认证基本要求 1. 产品分类- II类医疗器械:产品代码为FRH- 510(k)通道:大多数医用冷藏箱适用- 特殊控制:需要满足性能标准要求 2. 适用标准- IEC 60601-1:医用电气设备安全要求- IEC 61010-2-011:制冷设备特殊要求- 21 CFR Part 880:通用医院设备要求 ...
-
医用冷藏箱FDA认证临床数据要求与准备
医用冷藏箱作为II类医疗器械,FDA认证过程中需要提供充分的临床证据证明产品的安全性和有效性。本文将详细解析临床数据要求及准备要点,帮助企业高效完成认证。 一、医用冷藏箱FDA认证临床数据要求概述 1. 临床数据构成- 临床文献:已发表的同类产品临床研究- 临床经验:现有类似产品的使用数据- 临床试验:新产品进行的临床研究数据- 不良反应:现有产品的不良事件报告 2. 数据要求等级- 510(k)途径:主要通过等同性比较证明安全性- PMA途径:需要提供原始临...
-
乳制品FDA认证现场检查准备与应对策略
乳制品生产企业接受FDA现场检查是确保产品符合美国食品安全要求的必要环节。良好的准备工作和正确的应对策略不仅能帮助企业顺利通过检查,更能借此提升质量管理水平。 一、乳制品FDA认证检查前准备阶段 1. 文件资料准备- 质量体系文件:HACCP计划、SSOP、GMP等相关文档- 生产记录:最近6-12个月的生产、检验和监控记录- 培训记录:员工食品安全和卫生培训档案- 设备维护:设备校准和维护保养记录- 客户投诉:投诉处理和召回记录 2. 现场环境准备- 卫生清...
-
婴幼儿配方乳粉FDA认证附加要求详解
婴幼儿配方乳粉FDA认证除遵循食品和药品一般要求外,还需符合一系列针对婴幼儿食品的附加特殊要求。这些要求涵盖配方标准、生产规范、标签标识等各个方面,确保产品安全性和营养充足性。 一、婴幼儿配方乳粉FDA认证法规框架与适用范围 1. 核心监管法规- 联邦食品、药品和化妆品法案(FD&C Act)第412节- 21 CFR Part 106:婴幼儿配方乳粉质量控制程序- 21 CFR Part 107:婴幼儿配方乳粉标签、召回和注册要求 2. 产品适用范围...
-
获得FDA认证的医用清洗器需要满足哪些要求?
医用清洗器FDA认证是产品进入美国市场的强制性要求,证明产品符合美国食品药品监督管理局的安全性和有效性标准。认证过程严格复杂,需要满足技术文件、质量管理、临床评估等多方面要求。 一、医用清洗器FDA认证基本要求 1. 产品分类确定- I类医疗器械:低风险产品,通常豁免510(k)- II类医疗器械:中风险产品,需要510(k)预市通知- III类医疗器械:高风险产品,需要PMA审批 2. 适用法规- 21 CFR Part 807:医疗器械上市前通知要求- 2...
-
家用呼吸机FDA认证的关键测试项目
家用呼吸机作为II类医疗器械,FDA认证过程中需要完成一系列关键测试项目。这些测试确保设备的安全性、有效性和可靠性,是获得510(k)许可的重要基础。 一、家用呼吸机FDA认证性能测试 1. 基本性能验证- 气流精度测试:测量流量输出准确性,误差需在±10%以内- 压力精度测试:验证压力输出稳定性,包括IPAP和EPAP压力- 呼吸频率测试:确保呼吸频率输出符合设定值- 氧浓度测试:对于带氧疗功能设备,测试氧浓度输出精度 2. 模式功能测试- CPAP模式测试...
-
如何办理家用呼吸机FDA认证?
家用呼吸机在美国属于II类医疗器械,必须通过FDA认证方可上市销售。认证过程涉及严格的技术审查和质量管理体系要求,确保设备的安全性和有效性。 一、家用呼吸机FDA认证前准备工作 1. 产品分类确认家用呼吸机通常归类为II类医疗器械,产品代码为NOU(呼吸机,连续设施使用)。需确定具体分类编号和适用法规要求。 2. 实质性等效判定寻找已获批准的对比设备(predicate device),证明新产品与现有合法设备在安全性和有效性方面实质等效。 3....