FDA代表食品和药品管理局,是美国的一个监管机构,负责食品、膳食补充剂、药品、疫苗、和其他生物制剂、医疗设备、放射电子产品、化妆品、兽医产品和在美国销售或制造的烟草产品的安全管理,这些产品出口必须要做FDA注册才能顺利出口美国,FDA还检查和执行与这些行业有关的规定,不符合要求的会被FDA扣留。

食品FDA注册
3~5天完成注册,每偶数年更新注册,从事食品制造、加工、包装或储存销售的企业,在美国必须做(FDA)注册
医疗器械FDA注册
1~2周完成,每年年底更新注册,从事生产、配制、传播、合成、组装、加工或进出口医疗器械的企业必须在FDA进行注册

化妆品FDA注册
每2年更新,凡在美国销售的化妆品,无论是本地制造还是外国进口,都必须遵守制定化妆品自愿注册计划

药品FDA+DMF注册
每年更新注册,生产预期用于疾病的诊断、治疗、症状缓解、处理或疾病的药品工厂必须向FDA进行注册并申报其所有成分
[推荐]什么是fda注册FDA检测和FDA批准?
FDA注册的意思是: FDA Registered ImageFDA代表食品和药品管理局,是美国的一个监管机构,负责食品...
[推荐]FDA认证简单基础知识,一看就明白了
什么是FDA认证? FDA认证是指美国食品药品监督管理局(FDA)对医疗器械、药品、食品和化妆品等产品进行监管和审批的过...
-
化妆品FDA注册全攻略:轻松掌握合规要点
美国的化妆品管控背景: 化妆品FDA指的是美国食品药品监督管理局(Food and Drug Administration)对化妆品进行注册和监管的过程,FDA是美国联邦政府机构,负责确保化妆品在市场上的安全性和合规性。2022年12月29日,美国总统签署通过了《2022年食品和药品综合改革法案》(FDORA),其中包括了一直备受关注的《2022年化妆品法规现代化法案》(MoCRA)。 新法案旨在对美国化妆品法规及安全标准现代化,授予了FDA新权限,同时也为化妆品...
-
DMF认证是什么意思?DMF认证能替代FDA吗?
DMF认证是什么意思? DMF认证,即药物主文件(Drug Master File,简称DMF),是一种提交给美国FDA的保密文件,包含有关药品生产、加工、包装和储存过程中使用的设施、工艺流程、质量控制及其所用原料、包装材料等详细信息。DMF的主要目的是支持用户向FDA提交的各种药品申请,同时保护DMF持有者的商业机密。DMF认证主要特点:1. 保密性:DMF持有者只需向FDA提供资料,而不需要将这些资料提供给用户,从而保护了生产和工艺的机密信息。2. 支持多种申请:DMF可以...
-
3分钟看懂-美国药物主文件DMF申报流程和管理制度
药品的出口至美国市场需要遵循严格的法规和管控政策,OTC、处方药、原料药以及包装材料的进口管理。美国食品药品监督管理局(FDA)是主要的监管机构,其对药品的进口有明确的要求和程序。 OTC、处方药一般做FDA NDC注册以及ANDA注册,原料药、辅料、包材一般做DMF药物主文件。什么是DMF药物主文件? 美国药物主文件(Drug Master File,简称DMF)是由药物制造商、药物成分供应商或包装材料供应商等提交给美国食品药品监督管理...
-
药品主文件(DMF)注册备案指南
什么是药物主文件? 药品主文件是一份机密文件,涵盖生物制品、药物和器械产品制造、加工、包装和储存过程中使用的设施、流程和物品的详细信息。主文件还可能涵盖其他类型的信息,包括毒理学和共享系统风险评估和缓解策略 (REMS)。 主文件由制造商直接提交给美国食品药品管理局 (FDA),随后可在申请人或赞助商向 FDA 提交的申请中引用。这样,制造商可以保护其知识产权信息不被泄露给申请人或赞助商,同时允许申请人或赞助商遵守监管要求,将信息作为向 FDA 提交申...
-
什么是中国药物主文件?NMPA和CDE注册怎么做?
什么是中国药品管理文件? 中国国家药品监督管理局 (NMPA) 于 2017 年底引入了新的药品主文件 (DMF) 注册系统,大大减少了新药进入中国市场的成本和时间。 它不仅有利于更好地保护原料药、辅料和包装材料制造商的知识产权,还简化了新药上市的审批流程。值得注意的是,新规定规定,海外公司应在中国指定当地代表/代理人。NMPA 和 CDE 是什么单位?中国的主管部门分为三层,即立法机关(第一层)、监管部门(第二层)、技术执行机构(第三层)。国会和国务院 主要负责...
-
DMF注册资料_美国药物主文件详细内容清单
DMF(Drug Master File,药物主文件)是药品生产商向美国食品药品监督管理局(FDA)提交的文件,用于提供关于药品的生产工艺、质量控制、稳定性数据等详细信息。CTD文件主要内容:模块1:行政描述信息(不属于CTD)模块2:通用技术文件总结(专家报告)模块3:质量(DMF)模块4:非临床研究报告(不涉及)模块5:临床研究报告(不涉及)DMF注册资料明细:模块I区域行政信息-各个区域要求的行政/声明文件;模块II通用技术文件总结(Q0S,专家报告)应该由有资格的人员,对DMF文...
-
原料药美国DMF备案不需要获批吗?
在美国,原料药的DMF(Drug Master File)备案本身并不需要获得审批。DMF是一种提交给FDA的文件,其中包含了有关原料药的详细制造过程、控制方法、质量数据和稳定性数据等信息。这些信息并不会直接导致FDA对原料药的批准或拒绝,而是作为支持文件,供与此原料药相关的具体药品申请(如NDA、ANDA或BE评价)使用。具体来说:1. DMF的角色:DMF不是一种批准或许可文件,而是一种提交给FDA的机密文件。它的目的是提供有关原料药的关键信息,以支持FDA对使用该原料药的具体药品申...
-
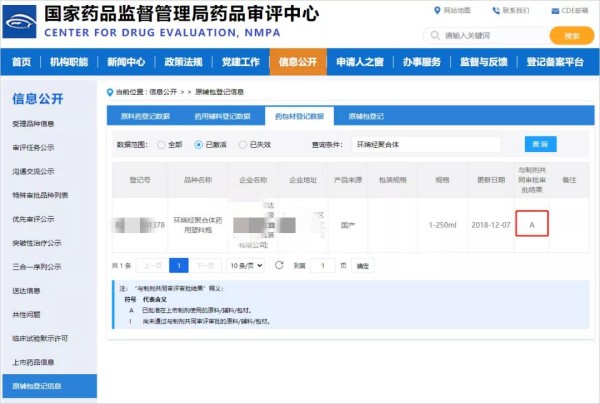
DMF状态为A就可以卖到美国吗?
DMF状态为A就可以卖到美国吗? 在美国药品管理中,DMF(Drug Master File)状态并不直接决定原料药是否可以销售到美国,而是用于支持与原料药相关的具体药品申请,如新药批准(NDA)、通用药物申请(ANDA)或生物等效性评价(BE)。 具体来说,DMF有不同的状态,其中"A"状态表示该DMF已被FDA接受,并且在有效期内。这意味着原料药供应商或制药工艺的提供者可以引用该DMF来支持他们的具体药品申请。但DMF状态为"A&...
-
中国dmf备案是什么?
中国dmf备案是什么? 中国DMF备案是指在中国,所有的原料药(除了创新药物的原料药)、辅料(除了豁免清单)和包装材料需要在中国药品审评中心(CDE)注册,并公布在CDE网站上的过程。 在中国,药品主文件(DMF)的备案管理相较于美国FDA的药品主文件(DMF)更为严格。FDA的DMF是自愿提交的信息,旨在提供人类药品生产、加工、包装和储存过程中使用的设施、工艺或物品的详细机密信息,而制造商向FDA提交这些信息并非强制性。 然而,在中国,...
-
原辅包美国DMF注册常见问题解答
问:谁可以提交DMF?答:药企和贸易商都可以提交DMF,DMF是由药物制造商、原料供应商或其他与药物生产相关的实体提交的。这些实体必须拥有合适的法律地位和资质来提供所需的信息。问:DMF的审批过程是怎样的?答:DMF本身并不会被FDA审批。相反,DMF会被FDA注册,并获得一个唯一的编号。一旦注册,该DMF编号可以被其他制药企业引用,以支持他们的药物注册申请。FDA会对DMF进行评估,确保其中的信息是准确、完整且符合要求的。问:DMF是如何保密的?答:DMF是机密文件,其内容仅供FDA评估和监管使用。制药企业可以要...
-
原料药DMF注册-从资料准备到拿号的10个关键步骤
原料药DMF注册: 原料药DMF注册在美国药品注册中扮演着至关重要的角色,DMF注册可以帮助原料药生产商避免重复提交原料药的相关资料,从而简化药品注册申请的流程。 药品注册申请人可以通过引用DMF中的信息来支持其申请,无需再提供详细的原料药生产和质量信息。这可以大大缩短药品注册的审批时间,并降低药品注册的成本。原料药DMF递交及审评流程:一、递交前准备在递交原料药DMF之前,您需要做好充分的准备工作,包括:1.熟悉FDA的DMF相关指南和要求,例如《D...
-
原料药和辅料美国DMF注册有什么区别?
美国药物主文件DMF注册制度: 美国DMF(Drug Master File)是由美国食品药品监督管理局(FDA)管理的一种注册制度,用于原料药/辅料、包材、中间体、赋形剂、着色剂、香料的注册申请。DMF反映药品生产和质量管理方面的一套完整的文件资料。主要包括生产厂简介、具体质量规格和检验方法、生产工艺和设备描述、质量控制和质量管理等方面的内容。原料药和辅料在美国DMF注册方面有一些区别。原料药和辅料DMF注册的主要区别:1. 适用范围: - 原料药:美国DMF注册...
-
原料药/辅料欧洲药物主文件 (EDMF) 注册的关键文档和步骤
欧洲药物主文件 (EDMF) 注册是什么? 活性物质主文件,即Active Substance Master File(简称ASMF),通常也叫“欧洲药物主文件” ,即European Drug Master File(简称EDMF)。 欧洲药物主文件 (EDMF) 注册是欧洲药品质量管理局(EDQM)管理的一种注册制度,旨在支持原料药和辅料的注册申请。申请人可以通过提交EDMF来证明其原料药或辅料符合欧洲药典的要求,EDMF的审核和评估由EDQM负责...
-
掌握FDA认证新政策,没有fda可以出口美国吗?
没有fda可以出口美国吗? 要看是什么产品,在FDA管控范围的产品出美国就需要满足FDA认证要求,如果不在FDA管控范围的产品可能需要满足其他认证要求,如FCC认证、cpc认证等。 根据美国的法规,所有出口到美国的食品、药品、医疗器械、化妆品、激光辐射类产品都需要遵守FDA(美国食品药品监督管理局)的要求,未经FDA批准的产品是不允许进入美国市场。因此,没有得到FDA注册或者批准的食品和药品无法出口到美国,出口到美国的商品一定要严格遵守FDA的相关规定...
-
药用辅料中国NMPA注册指南
药用辅料注册的重要性: 药用辅料(pharmaceutical excipients)是指在制剂处方设计时,为解决制剂的成型性、有效性、稳定性、安全性加入处方中除主药以外的一切药用物料的统称。 药用辅料是药物制剂的基础材料和重要组成部分,是保证药物制剂生产和发展的物质基础,在制剂剂型和生产中起着关键的作用。它不仅赋予药物一定剂型。而且与提高药物的疗效、降低不良反应有很大的关系,其质量可靠性和多样性是保证剂型和制剂先进性的基础。 ...
-

 关于商通检测
关于商通检测深圳市商通检测技术有限公司是一家第三方认证咨询公司,为国内外企业提供有关FDA法规全方位咨询服务。如果您正在寻求有关美国产品认证法规帮助,商通检测是您不错的选择,我们经验丰富的工程师可以为您提供产品出口美国法规指导。