医疗fda认证
-
医疗器械企业FDA认证和上市注册服务
医疗器械企业FDA认证和上市注册服务: 参与医疗器械制造、测试、包装、标签、灭菌或进口的公司必须注册其设施,支付 FDA 注册费,并在 FDA 列出其设备。医疗器械企业还必须每年审查其医疗器械企业注册和上市信息,并更新其注册。如果您是第一次注册 I 类产品,我们还可以协助评估分类并为您的医疗设备选择合适的产品代码。商通检测以非常优惠的价格提供FDA 医疗器械注册和上市服务,凭借多年的经验,我们可以就医疗器械的所有监管要求提供专家建议。2024年FDA医疗器械注册年金是多少?2...
-
FDA注册510(K)提交的关键信息要求
FDA注册510(K)市场前通知计划的主要目的是医疗设备,这些医疗设备“实质上等同于”其他医疗设备,这些医疗设备此前已获得美国食品和药物管理局(FDA)的市场许可。 在这方面,实质等同是指设备的设计、结构、使用标志、安全性能、有效性和任何其他适用特性等因素。因此,510(K)提交材料所提供的信息的范围和深度必须足以使FDA审查员确定所述医疗设备是否基本上等同于已识别的谓词设备。以下是林业局对所有510(K)份提交材料所要求的具体信息的...
-
什么是医疗器械唯一设备识别UDI?
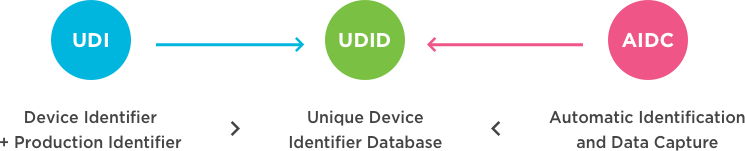
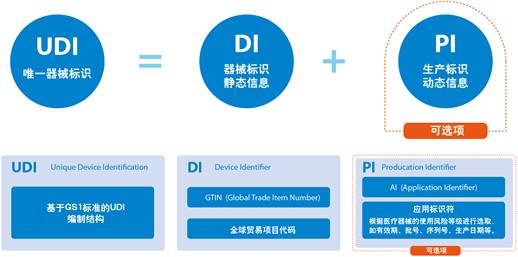
什么是UDI? 一种独特的设备识别(UDI)系统旨在通过分发和使用提供单一的、全球统一的医疗设备的阳性标识,要求设备的标签必须具有全球唯一的设备标识符(通过使用自动识别和数据捕获,并在适用情况下使用其人类可读的解释),并根据标准提供UDI-DI(设备标识符),该唯一标识符的UDI-DI(设备标识符)也链接到特定管辖权的公共UDI数据库(来源:国际医疗设备监管机构论坛(IMDRF): 这个美国食品和药物管理局(FDA),欧盟委员会其他监管...
-
医疗器械FDA认证唯一设备标识符(UDI)
医疗器械FDA认证唯一设备标识符(UDI) FDA已经建立了独特的设备识别系统,可以通过医疗设备的分发和使用(以人类可读的纯文本和AIDC技术之类的机器可读格式)来充分标记和识别医疗设备。在设备标签和设备包装上以及在某些情况下在设备本身上都要求使用UDI,除非FDA允许例外或替代。如果要多次使用该设备并在两次使用之间进行重新处理,则需要在该设备本身上直接标记UDI。永久性的UDI可以采用纯文本格式,AIDC技术或两者均可:1.每个医疗设备(包括所有IVD)的标签都必须具有UD...
-
医疗器械FDA注册上市前通知510K详细介绍
医疗器械FDA注册510K介绍: 医疗器械FDA注册FDA 510(K)是向FDA提交的市场前提交的报告,目的是证明所销售的设备至少与不经市场前批准(PMA)的合法销售的装置一样安全和有效。510(K)提交人必须将其设备与一个或多个类似的合法销售装置进行比较,并提出和支持其实质性的等同索赔。 食品和药物管理局(FDA)内的设备和放射健康中心(CDRH)审查和处理了FDA 510(K)提交的医疗设备。在提交人收到宣布设备SE的命令之前,提交...
-
医疗器械FDA认证I,II或III类设备怎么区分?
美国FDA规范在美国销售的所有医疗器械,这些医疗器械分为三大类。FDA批准的任何医疗器械都将根据其风险,侵袭性以及对患者总体健康的影响分为I,II或III类。但是,这三个类别之间的界限在哪里,为什么? 美国FDA的分类准则可能会使医疗器械制造商对系统的接触程度极度混乱。根据设备的分组方式,制造商的最佳市场开发途径存在巨大差异。与II类或III类设备相比,I类设备受到的法规要求要少得多。通过了解FDA医疗器械类别中的差异,您可以了解如何...