2025最新轮椅FDA注册攻略:510(k)预市通知详解
轮椅通常属于 FDA II 类医疗器械。需根据其预期用途、特性和风险级别,参考 FDA 的医疗器械分类规定及相关指南,准确确定产品分类,以明确适用的法规和标准。

一、2025年FDA 510(k)新规要点
1. 适用范围
电动轮椅(Class II,产品代码ITI)
手动轮椅(Class I,部分型号可能豁免510(k))
智能轮椅(含AI导航等新功能需额外审查)
2. 2025年关键更新
新增网络安全要求:电动轮椅需提交网络安全风险管理文件
真实世界数据(RWD):允许使用临床使用数据替代部分性能测试
eSTAR强制化:2025年起所有510(k)必须通过电子提交模板
二、510(k)申报核心流程
1.确定产品分类
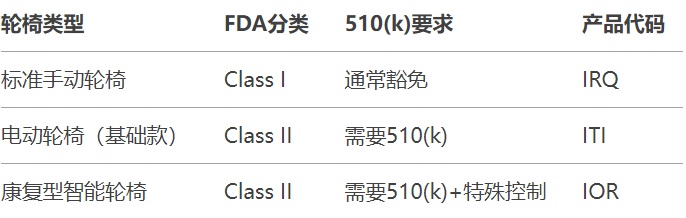
2.测试要求
安全性测试:
电气安全:IEC 60601-1(第3.2版)
电磁兼容:IEC 60601-1-2
性能测试:
动态稳定性测试(斜坡倾角≤10°)
续航测试(电动轮椅≥15km)
网络安全测试(仅智能轮椅):
数据加密验证(如AES-128)
漏洞扫描报告
3.文档准备
1. 行政信息(企业DUNS编号、FDA Establishment ID)
2. 器械描述(技术规格、使用场景)
3. 对比器械分析(SE表格)
4. 性能测试摘要(附ISO 7176系列测试报告)
5. 生物相容性报告(接触部件需ISO 10993)
6. 标签与说明书(含FDA要求的警告语句)
4.提交与审核
审核时间:FDA目标为90天(复杂产品可能延长)
常见缺陷:
对比器械论证不充分(占拒批原因的42%)
测试数据未覆盖最坏使用场景

三、2025年合规策略
1. 提前验证对比器械
通过FDA的De Novo分类数据库确认产品是否可归为Class I(豁免510(k))
2. 利用简化路径
Abbreviated 510(k):使用FDA认可标准(如ANSI/RESNA WC-1)可减少测试项目
3. 智能轮椅特别注意事项
需提交算法验证资料(符合FDA AI/ML行动计划)
数据接口需符合HL7/FHIR标准










