欧盟CEP、EDMF/ASMF、COS证书核心区别解析
在欧盟原料药注册体系中,CEP(欧洲药典适用性证书)、EDMF(欧洲药物主文件,现称ASMF)和COS(CEP的旧称)常被混淆。本文从法律性质、适用场景、申报路径三维度厘清差异,助您精准选择合规路径。
一、术语定义与演进
| 简称 | 全称 | 状态 | 说明 |
| CEP | Certification of Suitability to Monographs of European Pharmacopoeia | 现行 | 证明原料药符合欧洲药典(EP)标准的证书 |
| COS | Certificate of Suitability | 已废止 | CEP的旧称(2010年后统一改为CEP) |
| EDMF | European Drug Master File | 已升级 |
重要提示:
COS就是CEP,仅为名称变更,实质要求未变;
EDMF已全面被ASMF替代,两者为同一概念。
二、核心差异对比
| 维度 | CEP(COS) | ASMF(原EDMF) |
| 法律性质 | ✅ 独立证书(全欧盟通用) | ❌ 非独立证书(依附于制剂上市许可申请MA) |
| 适用对象 | 已收录于欧洲药典(EP)的原料药 | 未收录于EP的原料药/专利保护品种 |
| 数据公开性 | 工艺和质量数据向EDQM公开 | 分为公开部分(给监管机构)与保密部分(仅制剂厂商可见) |
| 审批机构 | 欧洲药品质量管理局(EDQM) | 欧盟成员国药监局(如德国BfArM、法国ANSM) |
| 审批时间 | 10-18个月 | 与制剂MA绑定(12-24个月) |
| 续期要求 | 每5年更新药典符合性 | 随制剂MA更新(无固定周期) |
三、典型应用场景与案例
1. CEP(COS)适用场景
案例:布洛芬原料药(已收录于EP专论)
优势:
一证通行欧盟31国;
无需重复提交资料,降低客户合规成本。
2. ASMF(原EDMF)适用场景
案例:某专利保护的ADC药物毒素分子(未收录于EP)
优势:
保护工艺机密(保密部分不公开);
适配不同制剂客户的质量标准(如不同规格要求)。
四、申报路径与资料要求差异
1.CEP申报核心流程

资料重点:
生产工艺与EP专论一致性;
杂质谱研究(尤其基因毒性杂质);
稳定性数据(加速6个月+长期)。
2. ASMF申报核心流程

公开部分:质量控制策略、分析方法;
保密部分:合成路线、关键工艺参数。
五、选择策略:CEP or ASMF?
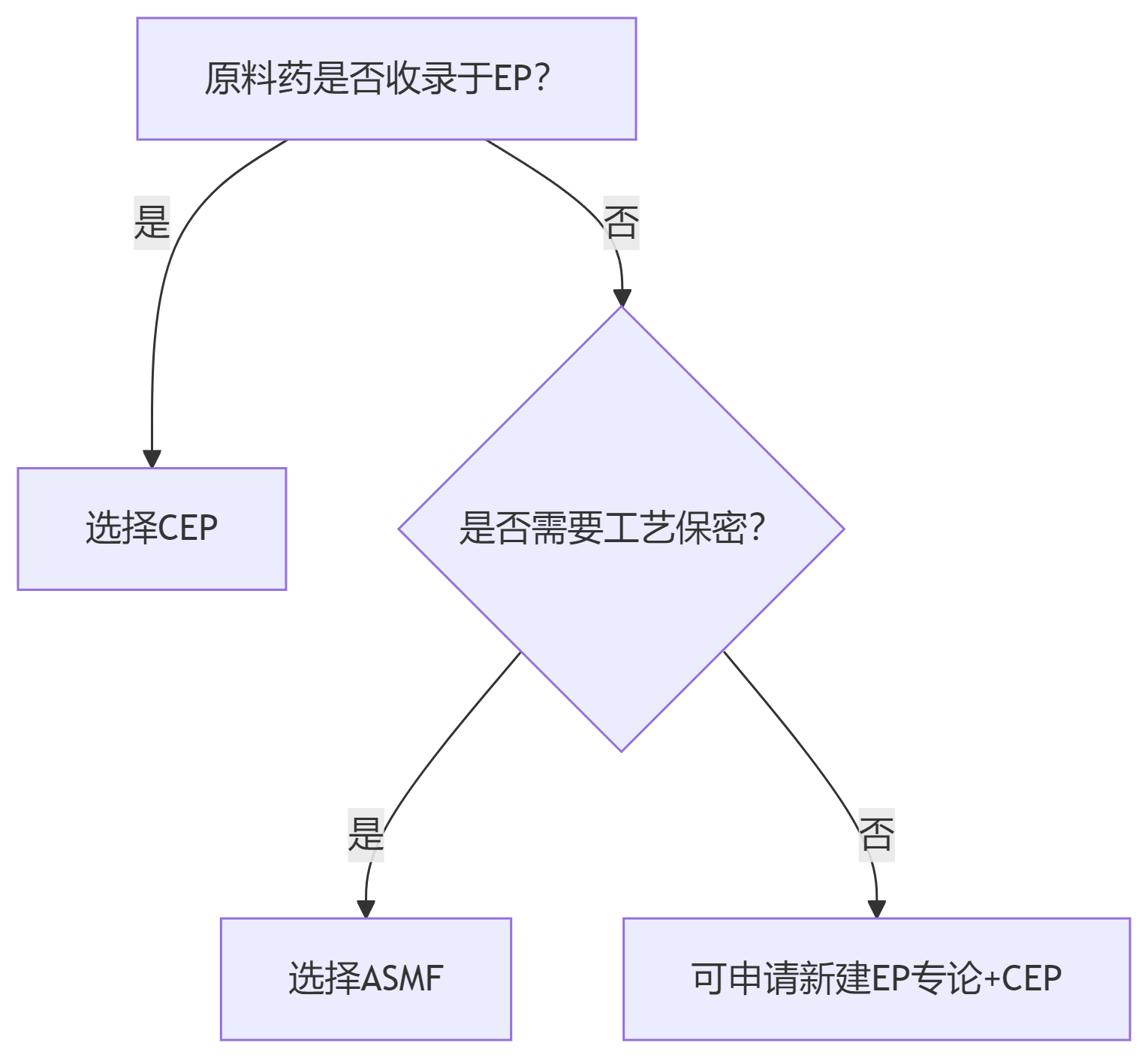
优选ASMF:专利化合物、定制合成中间体。
六、常见误区澄清
“CEP比ASMF更高级”
❌ 二者无优劣之分,仅适用场景不同:CEP适合标准化大品种;
ASMF适合专利/定制化品种。
“ASMF无需官方审批”
❌ ASMF虽无独立证书,但需通过欧盟药监局技术审评(标准与CEP一致)。“同一产品不可双路径申报”
✅ 可同时申请CEP与ASMF,但需确保数据一致性(如杂质控制策略相同)。
七、总结:核心区别一句话概括
注:COS是CEP曾用名,EDMF是ASMF曾用名,勿被历史术语混淆!
商通医药相关服务:
商通医药专注于原辅包、化学药品及生物制品领域,提供专业的 GMP 合规咨询与注册办理服务。商通致力于协助医药企业搭建或优化符合中国、美国、欧盟、日本等国家和地区要求的药品质量体系。
服务过程中,我们首先开展现场考查与现状评估,结合企业实际情况定制专属项目方案。以注册资料、GMP 法规及指南为依据,指导企业对生产现场的 GMP “软”“硬” 件进行整改完善。
从制度流程到设施设备,全方位助力企业做好 “GMP 符合性检查” 前的准备工作,确保顺利通过 GMP 现场检查。










