化妆品FDA微生物污染美国药典测试标准(USP 61 & 62)
化妆品FDA生物含量测试:USP <61> 和 <62>
USP <61> 和 USP <62> 是主要用于评估原材料、非无菌药品、OTC 成品、个人护理/化妆品和营养补充剂的测试。USP <61> 涉及对存在的总细菌、酵母或霉菌进行计数的定量测试,而 USP <62> 筛选特定有害微生物的存在/不存在。这些方法与欧洲药典 EP 2.6.12 和 2.6.13 协调一致。CPT 还 根据 USP <60>对洋葱伯克氏菌进行适用性和筛选。
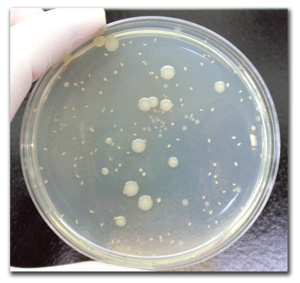
USP <61> 非无菌产品的微生物检验:微生物计数试验
USP <61> 是一种定量测试(平板计数),用于计算可能存在于非无菌产品中的细菌和真菌。执行的测试是总需氧微生物计数 (TAMC) 和总酵母菌和霉菌计数 (TYMC)。
USP <62> 非无菌产品的微生物检验:特定微生物的检验
USP <62> 显示定性测试,确定非无菌产品中是否存在特定有害微生物或潜在致病微生物。
USP61&62检测的菌种包括:
1.耐胆汁革兰氏阴性菌
2.大肠杆菌
3.沙门氏菌种
4.铜绿假单胞菌
5.金黄色葡萄球菌
6.梭菌属
7.白色念珠菌
测试周期:常规10-12个工作日
USP <61> 和 <62> 测试方法适用性:
在对任何特定产品或材料类型执行 MLT 测试之前,USP 要求执行方法适用性。这是为了确保产品/材料不会抑制可能存在并可能导致“假阴性”测试结果的生物体的恢复。产品/材料中存在的任何抗菌特性都可以在测试产品或材料之前通过稀释、过滤、中和或灭活来消除。这决定了用于常规测试该产品或材料的有效稀释度。
USP <1111> 非无菌产品的微生物检验:药物制剂和药用物质的验收标准
本一般信息章节根据产品的性质及其给药途径提供了微生物规格建议。这些信息应在提交样品进行这些章节的测试方法适用性测试时提供给测试实验室。
在对产品进行 MLT 测试之前,必须验证该方法以确保产品不具有可能导致假阴性的微生物抑制特性。此验证测试称为 MLT 方法适用性测试。如果存在这些抗菌特性,则可以在测试产品之前通过稀释、过滤、中和或灭活来消除这些特性。
微生物限度测试的相关标准已针对美国、欧洲、英国和日本市场进行协调。微生物限度测试通常按照 cGMP 进行,应由 GMP 微生物实验室进行。MLT 测试通常针对从原材料到成品的非无菌药品、保健品和化妆品进行。
可用的药物微生物限度测试服务:
1.MLT 方法适用性测试
2.微生物计数(总需氧微生物计数和总结合酵母菌和霉菌计数)
3.特定微生物筛选试验:
A、铜绿假单胞菌
B、大肠杆菌
C、金黄色葡萄球菌
D、沙门氏菌
E、耐胆汁革兰氏阴性菌
F、白色念珠菌
G、梭状芽胞杆菌
H、B. cepacia复合体 (Bcc)
商通检测提供化妆品的FDA注册以及相关测试服务!










