中国药品eCTD电子递交与国际核心差异分析
一、法规框架与实施背景:
中国药品电子通用技术文档(eCTD)的实施标志着药品注册审评与国际接轨的重要一步。根据NMPA发布的《药品电子通用技术文档结构(试行)》(2021年),中国eCTD在借鉴ICH M4和ICH eCTD规范的基础上,结合本土监管需求进行了适应性调整。其核心差异主要体现在区域性模块设计、技术验证标准及审评流程衔接上。

1. 实施背景
国际接轨需求:中国加入ICH后,推动eCTD成为药品全球同步开发的必要工具;
审评效率提升:通过结构化数据减少纸质递交的审评延迟;
监管透明化:电子化递交便于数据追溯与生命周期管理。
2. 法规依据
核心文件:
《药品注册管理办法》(2020年修订)第四十四条,明确eCTD递交要求;
《药品电子通用技术文档结构(试行)》(2021年),规定技术细节;
《eCTD验证标准与实施指南》(NMPA,2022年更新)。
二、技术标准与结构差异
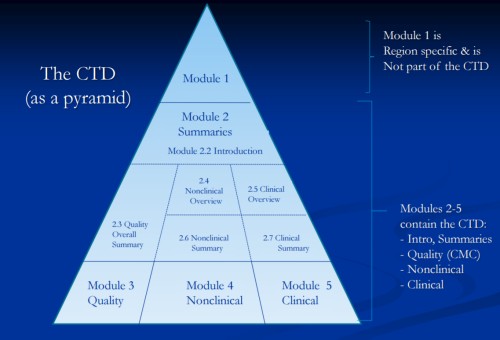
1. 区域性模块(Module 1)的特殊要求
中国eCTD的模块1(地区性信息)与其他地区差异显著,需包含以下本土化内容:
| 子模块 | 中国特有要求 | 对比FDA/EMA |
| 1.2 申请表 | 需嵌入“药品注册申请码”(由NMPA系统生成) | 美国:无类似编码;欧盟:需EMA申请号 |
| 1.3 药品说明书 | 强制提交中英双语版本(格式需符合《中国药品说明书规范》) | 欧美:单语种(英文或成员国语言) |
| 1.8 沟通记录 | 要求包含与CDE的pre-IND会议纪要及官方回复原件 | 美国:仅需提交会议申请与FDA回复摘要 |
2. 技术验证标准差异
中国eCTD验证标准在ICH基础上增加本地化规则:
文件格式:PDF必须为PDF/A-1a标准(FDA接受PDF/A-1b);
书签层级:目录书签需严格匹配《中国eCTD结构标签列表》,允许层级深度不超过5级;
元数据:强制要求嵌入“申请人名称拼音”及“药品通用名拼音”字段。
典型案例:某进口药因未按中国规范标注“药品注册申请码”,被NMPA系统自动拒收。
三、提交流程与审评机制差异
1. 递交平台与流程
| 维度 | 中国(NMPA) | 美国(FDA) |
| 递交平台 | 国家药监局药品业务应用系统(需CA数字证书认证) | FDA ESG网关 |
| 受理审查 | 5个工作日内完成格式验证(超期自动退回) | 7日内完成技术验证(Technical Rejection) |
| 滚动提交 | 仅允许临床试验申请(IND)分阶段提交 | 支持IND/NDA滚动提交 |
2. 审评交互机制
缺陷反馈:中国CDE通过“申请人之窗”在线发送发补通知,企业需在80日内回复(FDA为30~60日);
审评状态追踪:NMPA不提供公开的审评时钟(如FDA的PDUFA日期),企业需主动登录系统查询。
四、挑战与应对策略
1. 典型挑战
双语提交压力:模块1中英文件需严格对应(如说明书、标签),翻译错误可能导致发补;
系统兼容性问题:国内eCTD生成软件对PDF/A-1a支持不足,易出现验证失败;
过渡期衔接:2023年1月1日起化学药强制eCTD,但部分省级药监部门仍要求纸质备份。
2. 应对策略
工具选择:采用通过NMPA验证的eCTD生成软件(如灵思、易启);
双语管理:建立中英文术语库,确保翻译一致性;
预验证机制:提交前使用NMPA官方验证工具(eCTD Validator)进行本地检测。
五、未来趋势与建议
1. 技术升级方向
结构化数据深化:推动非临床与临床数据的结构化提交(如SDTM、SEND格式);
人工智能审评:试点AI辅助审评工具(如自动识别药学数据趋势)。
2. 企业准备建议
人才储备:培养兼具药学知识与IT技能的复合型人才;
流程重构:将eCTD要求嵌入研发早期(如临床前研究阶段);
国际合作:针对中美双报项目,设计“主文件+区域模块”的协同架构。
六、总结
中国eCTD的实施不仅是技术规范的转变,更是药品全生命周期管理理念的革新。其与FDA、EMA体系的差异,既反映了监管的本土化需求,也为企业带来数据标准化与审评效率提升的双重机遇。未来,随着NMPA与国际监管机构的进一步协同,eCTD将成为中国药企全球化竞争的核心能力之一。










