第24页
-
沐浴球上架美国亚马逊怎么做FDA认证?
沐浴球(如沐浴海绵、沐浴刷等)属于个人护理用品,通常需要满足美国食品药品监督管理局(FDA)的相关法规和要求,才能在美国市场上销售。一、沐浴球FDA认证产品分类 沐浴球属于化妆品和个人护理用品类别,受FDA的化妆品法规(21 CFR Part 700740)和《联邦食品、药品和化妆品法》(FD&C Act)的监管。二、沐浴球FDA认证主要要求成分合规性:沐浴球的成分必须符合FDA的要求,不能含有禁用或限制使用的物质。标签要求:产品标签必须符合FDA的规定,包括成分声明、使用方法、警示...
-
睫毛增长液出口美国做FDA注册流程
睫毛增长液属于化妆品和个人护理产品,但根据其功能和成分,可能会被归类为非处方药品(OTC)。在美国,OTC药品需要满足FDA的严格监管要求,包括注册、标签、成分合规性等。一、睫毛增长液FDA注册产品分类如果睫毛增长液仅作为美容产品,且不声称具有治疗或促进睫毛生长的药用效果,则可能被归类为化妆品。如果产品声称具有促进睫毛生长、治疗睫毛稀疏等功能,则可能被归类为OTC药品。重要提示:产品分类需根据产品标签、说明书和营销宣传来确定。如果产品被归类为OTC药品,需满足更严格的FDA要求。二、睫毛增...
-
假睫毛出口美国FDA认证全攻略
出口假睫毛到美国需要满足美国食品药品监督管理局(FDA)的相关法规和要求。假睫毛通常被归类为化妆品或医疗器械,具体分类取决于产品的设计、用途和营销声明。一、假睫毛FDA认证确定产品分类假睫毛通常被FDA归类为以下两种类别之一:1. 化妆品: 如果假睫毛仅用于美化外观(如增加睫毛长度或浓密度),则属于化妆品。 化妆品不需要FDA认证,但必须符合FDA的化妆品法规。2. 医疗器械: 如果假睫毛声称具有医疗用途(如帮助...
-
假睫毛fda认证是按照什么类型申请?
假睫毛出口到美国时,其FDA认证的申请类型取决于产品的具体设计、用途、使用方式以及营销声明。假睫毛可能被归类为化妆品或医疗器械。一、假睫毛fda认证的分类假睫毛通常被FDA归类为以下两种类型之一:1. 化妆品: 如果假睫毛仅用于美化外观(如增加睫毛长度或浓密度),则属于化妆品。 化妆品不需要FDA认证,但必须符合FDA的化妆品法规。2. 医疗器械: 如果假睫毛声称具有医疗用途(如帮助修复睫毛损伤或治疗睫毛脱落),...
-
假睫毛FDA认证是按照化妆品还是医疗器械?
假睫毛的FDA认证分类主要取决于其用途、使用方式和营销声明。通常情况下,假睫毛会被归类为化妆品或医疗器械。进行 FDA 注册是遵守美国相关法律法规的必要举措,能够避免产品因不符合规定而被拒绝入境、扣留或销毁,确保产品合法进入美国市场。一、假睫毛FDA认证的分类1.化妆品: 如果假睫毛仅用于临时美容目的,不涉及长期固定或医疗用途,则通常被归类为化妆品。这是最常见的分类方式。2.医疗器械 如果假睫毛的设计或用途超出了单纯的美容功能,可能会被归类为...
-
假睫毛fda认证主要要求和测试项目是什么?
假睫毛的FDA认证要求取决于其分类(化妆品或医疗器械)。假睫毛直接接触消费者的眼部,其安全性至关重要。通过FDA注册,企业需要确保产品成分安全、标签真实透明,且不含禁用物质。这不仅保护了消费者的健康,也避免了因产品质量问题导致的法律纠纷。一、假睫毛按化妆品FDA认证主要要求:1. 成分安全: 号 所有成分必须符合FDA的化妆品成分安全要求。 禁止使用FDA禁止的化妆品成分。2. 标签合规: 产品标签需符合FDA的化妆品...
-
脱毛膏FDA认证的流程是什么?
脱毛膏出口美国需要进行FDA认证,具体流程取决于其分类(化妆品或药品)。美国作为全球最大的化妆品消费市场之一,对于进口化妆品有着严格的监管要求。FDA 认证是脱毛膏进入美国市场的重要通行证,没有经过 FDA 认证的脱毛膏产品,将面临被美国海关扣留、拒绝入境甚至销毁的风险。一、脱毛膏FDA认证产品分类脱毛膏通常被FDA归类为以下两种类型之一:1. 化妆品: 如果脱毛膏仅用于美容目的(如去除多余毛发),则属于化妆品。 化妆品不需要FDA认证,...
-
羧甲基纤维素钠CMC-Na美国DMF注册全流程解析
美国DMF注册备案是指向美国食品药品监督管理局(FDA)提交药品主文件(Drug Master File,DMF)的过程。DMF是一份包含药品生产、加工、包装和储存过程中详细信息的机密文件,旨在帮助FDA全面了解药品的质量、安全性和有效性。一、CMC-Na的药用地位与DMF注册必要性: 1. CMC-Na的药用功能羧甲基纤维素钠(CMC-Na)是一种阴离子型纤维素醚,广泛用于制药行业作为:增稠剂:液体制剂(如滴眼液、混悬剂)的流变调节。粘合剂/崩解剂:固体制剂(片剂...
-
微晶纤维素药物主文件DMF注册备案是按照几类?
美国DMF注册备案是指向美国食品药品监督管理局(FDA)提交药品主文件(Drug Master File,DMF)的过程。DMF是一份包含药品生产、加工、包装和储存过程中详细信息的机密文件,旨在帮助FDA全面了解药品的质量、安全性和有效性。微晶纤维素(Microcrystalline Cellulose, MCC)在美国药物主文件(Drug Master File, DMF)可以按照II类或者IV类来注册。微晶纤维素DMF备案主要作用:1.支持药品申请:DMF可以支持新药申请(NDA)、...
-
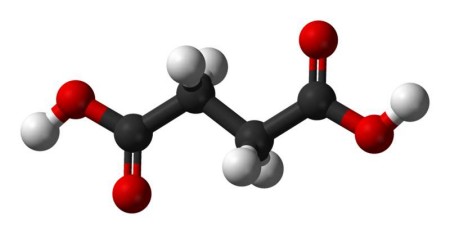
琥珀酸盐API原料药DMF注册具体要求及流程
琥珀酸盐(Succinate)作为药品的原料药(API,Active Pharmaceutical Ingredient)进入美国市场,通常需要向美国食品药品监督管理局(FDA)提交药物主文件(Drug Master File, DMF),以支持其在新药申请(NDA)、仿制药申请(ANDA)或生物制品许可申请(BLA)中的使用。一、琥珀酸盐DMF注册的必要性: DMF是原料药(API)或中间体生产商向FDA提交的保密技术文件,包含原料药的生产工艺、质量控制、稳定...
-
纸质食品接触材料FDA认证怎么做?
纸质食品接触材料的FDA认证是指确保这些材料符合美国食品药品监督管理局(FDA)关于食品接触材料的安全要求。FDA(美国食品药品监督管理局)对食品接触材料(Food Contact Materials, FCMs)进行监管,确保其在与食品接触时不会对食品造成污染或危害人体健康。纸质食品接触材料(如纸杯、纸盘、食品包装纸等)需要通过FDA的合规性评估,以确保其符合相关法规要求。一、 纸质食品接触材料相关法规 确认产品是否属于FDA监管范围,并确定适用的具体法规,如21...
-
药用辅料/包材生产GMP质量管理2025年新规范要求
为贯彻相关法规,监督指导药用辅料、药包材生产企业规范生产,国家药监局组织NMPA制定了药用辅料附录、药包材附录,作为《药品生产质量管理规范(2010 年修订)》的配套文件予以发布,2026 年 1 月 1 日公告正式实施。旨在:1.填补监管空白:明确药用辅料和药包材的GMP要求,与原料药、制剂形成全链条质量管理体系。2.与国际接轨:参考ICH、USP等国际标准,提升中国药品供应链的全球合规性。3.强化风险管理:针对辅料和包材的关键质量属性(如功能性、安全性)提出更严格的控制措施。企业建立...
-
FDA认证流程详解,不同产品办理FDA认证的区别
美国食品药品监督管理局(FDA)的管辖范围包括食品、药品、医疗器械、化妆品、烟草制品等多个领域,旨在保护和提升美国人民的健康。FDA对不同类型的产品的认证流程各不相同,有些产品是填资料注册申报就行,有些产品需要产品检测,有些还需要完成临床试验才能获得FDA批准。一、食品FDA认证流程:食品的FDA认证主要是通过注册和通报来实现的。1.确定产品类别: 不同类型的食品(例如,新鲜农产品、加工食品、膳食补充剂)受不同法规管辖。2.符合现行良好生产规范 (cGMP): 生产设施必须符合FDA的...
-
药品申报CDE注册资料是什么格式?
药品申报资料在中国药品监督管理局药品审评中心(CDE)注册时,需遵循《药品注册管理办法》及相关技术指导原则。申报资料的格式通常为电子通用技术文档(eCTD)或非eCTD电子提交(NeeS)格式。药品申报CDE注册资料格式要求: 1. eCTD格式eCTD是国际通用的电子提交格式,中国也在逐步推行。- 文件结构:按模块组织,包括模块1(地区特定信息)、模块2(概述与总结)、模块3(质量部分)、模块4(非临床研究报告)、模块5(临床研究报告)。- 文件格式:PDF、XML等,需符合...
-
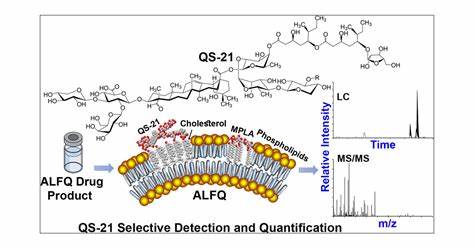
QS-21疫苗佐剂辅料DMF注册毒理数据要求解析
QS-21 作为辅料在美国的DMF注册,是否需要提供毒理数据,需结合其功能定位、FDA法规及佐剂特殊性综合判断。DMF文件包含有关药品、原料药、包装材料、助剂、配方和工艺等数据的详细信息,这些信息是机密的,主要用于确保药品的质量和安全性。一、疫苗佐剂DMF注册类型与基本要求:DMF类型:QS-21作为疫苗佐剂(辅料),需按 Type IV DMF(辅料、色素、香料等) 申报。核心内容:CMC信息(化学、制造与控制):合成/提取工艺、质量控制、稳定性数据等。功能合理性:佐剂在疫苗中的作用机...