太阳镜FDA认证为啥按照医疗注册?
太阳镜FDA认证:
无论您是将太阳镜进口到美国还是在美国商业上销售太阳镜,您都必须遵守美国食品和药物管理局 (FDA认证)的法律法规 。 FDA 对太阳镜产品进行监管以确保其安全性和抗冲击性。这些产品作为医疗器械受到监管,因为它们旨在减轻或防止太阳紫外线 (UV) 对人眼的影响。术语“医疗器械”在 21 CFR 201(h) 中有定义。
以下是适用于太阳镜的 FDA 规定。不遵守这些规定可能会导致 CBP 和 FDA 在美国入境口岸扣留您的太阳镜。
1.在 FDA 注册(制造商和美国进口商都需要);
2.外国制造商必须指定美国代理商;
3.制造商必须向 FDA 列出他们的设备;
4.制造商必须满足 21 CFR 820 中规定的质量体系 (QS) 要求,
5.眼镜和/或太阳镜镜片必须根据 21 CFR Part 801.410 获得抗冲击认证。
按照医疗器械注册您的太阳镜:
参与生产和分销拟在美国使用的太阳镜的营业场所(也称为机构或设施)的所有者或经营者必须每年向 FDA 注册。此过程称为企业注册 ( 21 CFR 807 )。注册和列名为 FDA 提供了医疗器械企业的位置以及在这些企业生产的器械。了解设备的产地可以提高国家准备和应对突发公共卫生事件的能力。
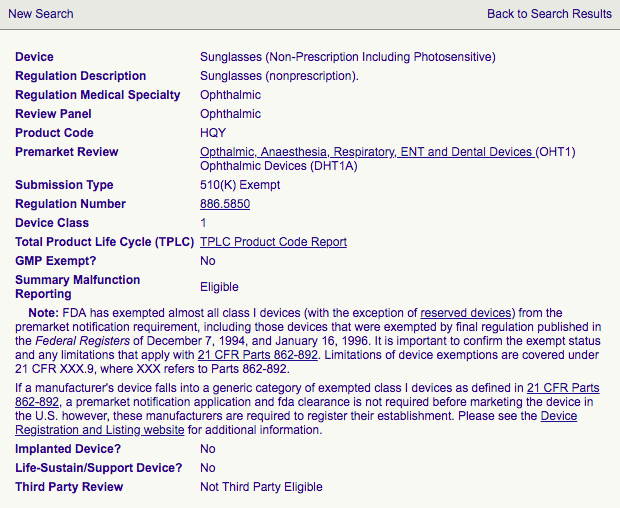
设备列表需要产品的类别和产品代码。以下法规编号和产品代码适用于太阳镜:

太阳镜FDA认证医疗器械分类:
设备列表需要产品的类别和产品代码,以下法规编号和产品代码适用于太阳镜:
I、II、III 类:您的医疗器械属于哪一类?
根据 21 CFR Parts 862-892,FDA将医疗器械分为 三个不同的类别,FDA 确定每个类别的监管控制水平:
I 类项目受到最低级别的审查,因为它们的风险级别较低。
II 类设备需要上市前通知 (510(k)),因为它们具有中等风险。
“ 510(k) 是向 FDA 提交的上市前提交,以证明待上市的设备至少与合法上市的设备一样安全有效,即实质上等效 (21 CFR 807.92(a)(3) ) 不受 PMA 约束。”
21 CFR §807 规定了满足 510(k) 提交的要求。正确提交 510(k) 后,您应该会收到一封 FDA 信函,通知您该设备实质上等同于合法销售的设备。然后您可以在美国以商业方式分销该设备。
III 类设备用于支持或维持生命,并遵守最严格的监管控制级别:需要 上市前批准 (PMA )。
产品代码
产品代码根据医疗器械的分类分配给医疗器械,分配给设备的产品代码基于 21 CFR Parts 862-892 指定的医疗设备产品分类。产品代码 有助于 CBP 官员、FDA 官员、进口商等准确识别医疗器械所属的类别并跟踪医疗器械。对于太阳镜(非处方包括光敏),产品代码为 HQY。
以下是FDA医疗器械数据库中提供的产品分类:
良好生产规范/质量体系要求
GMP/QS 要求见 21 CFR 820质量体系法规。质量体系法规包括与医疗器械的设计、采购、制造、包装、标签、储存、安装和服务所使用的方法以及设施和控制相关的要求。FDA 有一份有用的指导文件,名为“ 质量体系”。
太阳镜FDA认证冲击或落球测试:
进入美国市场后FDA将与美国海关和边境保护局 (CBP) 合作,通过审查入境确认将正确的文件传送给CBP。FDA需要检查您的入境包中的重要文件是“落球测试”证书。一个 证书说明与21 CFR 801.410镜头的合规性应伴随每批寻求进入美国的证书应该反映眼镜已经被‘采样’,且耐冲击,采用统计学方法显著太阳镜。

根据21 CFR 801.410,FDA要求您的太阳镜产品通过冲击或落球测试。该测试包括将不受限制的钢球掉落在您的太阳镜上,以测试太阳镜是否破裂。测试的重点是确定太阳镜的性能水平。
未能在您的条目中包含“落球”证书可能会导致 FDA 延迟您的发货,为避免任何延误,请确保将落球测试结果附在您的运输文件中。
进口警报 86-07:FDA 对不符合美国标准的“落球”证书采取强制措施:
最近,FDA 于 2018 年发布了 进口警报 86-07,允许对列入进口警报 86-07 红色清单的某些企业生产的太阳镜和眼镜进行扣留,无需进行体检。FDA 进口部 (DIO) 指示 FDA 地区办公室扣留来自红色清单中确定的制造商的产品,无需物理检查,因为 FDA 分析了它们在眼镜和太阳镜中的抗冲击镜片符合 21 CFR 801.410。请注意,虽然大多数进口警报是针对特定国家的,但进口警报 86-07 是全球范围的;这意味着从任何国家采购的进口商必须确认他们的制造商影响测试符合 FDA 标准。
唯一设备标识:
最后,FDA 需要唯一的设备标识 (UDI)。这是“旨在通过分发和使用充分识别设备”。 78 FR 58786。作为 UDI 规则 ( 78 FR 58785 ) 的结果, 每个 设备、标签和包装都需要其 自己的 唯一设备标识(除非已授予排除)。
UDI 由数字和字母变量的组合组成,代表 (1) 设备标识符和 (2) 生产标识符:
1.设备标识符 (DI),UDI 的强制性固定部分,用于标识标签者和设备的特定版本或型号(参见 21 CFR 801.3),
2.生产标识符 (PI),UDI 的有条件的可变部分,当包含在设备标签上时,可识别以下一项或多项:
a.制造设备的批号或批号;
b.特定设备的序列号;
c.特定设备的到期日期;
d.特定设备的制造日期;
e.§1271.290(c) 要求的用于作为器械监管的人体细胞、组织或细胞和组织产品 (HCT/P) 的独特识别码。
如何获得 UDI?
UDI 有非常具体的技术要求,这些要求在 21 CFR §830.20 中有规定。21 CFR §830.20 的技术性导致 FDA 要求 UDI 必须在由 FDA 认可的发行机构运营的系统下发行,并符合通过引用纳入 UDI 规则根据 21 CFR §830.10 的某些国际标准。至关重要的是,FDA 认可的发布机构发布 UDI 的系统与 UDI 标签要求保持一致,以确保贴标者能够自信地使用 FDA 认可的发布机构的系统来开发符合 21 CFR 下 UDI 标签要求的 UDI。
商通检测如何帮助您?
商通检测协助大型、中型和小型进口商进行FDA合规和相关合规测试服务,如果您不熟悉太阳镜的相关法规政策,我们强烈建议您咨询我们公司,因为您希望确保您的货物在进口时不被扣留,并且您的制造商远离进口警报 86-07。商通检测就如何在进口太阳镜之前预先遵守CBP和FDA提供专家建议。










