美国FDA和欧盟CE认证医疗器械风险分类
医疗器械风险分类概述
在准备医疗器械进入市场时,考虑医疗器械基于风险的分类可能是成功向监管机构提交的关键。下面,我们探讨了美国和欧盟 (EU) 医疗器械分类的差异(和相似之处)以及每个地区对不同器械分类。
FDA如何对医疗器械进行分类?
美国食品和药物管理局 (FDA) 根据对患者或用户的风险将医疗器械分为 I、II 或 III 级风险。设备风险级别通常是通过搜索 FDA 的设备分类数据库来查找“基本等效”的产品来确定的。总之,设备分为以下定义的基于风险的分类。
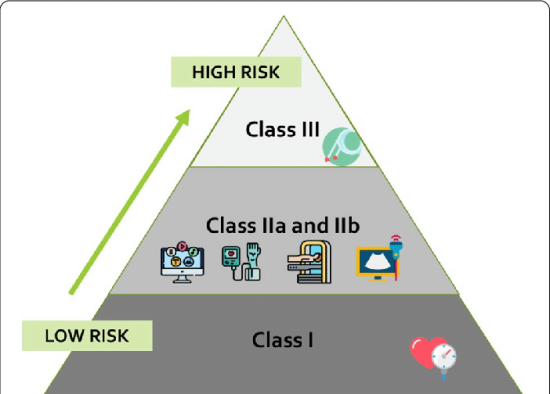
FDA对医疗器械的风险分类:
I 类医疗设备被认为风险较低,通常设计简单,没有移动部件。 此设备的示例风险类别包括创可贴、手术刀和手动听诊器。
II 类医疗设备属于中等风险,通常设计更为复杂,但其故障不太可能立即造成严重伤害或死亡的风险。例如内窥镜、电动轮椅、注射器和全关节植入物。比例最高的医疗器械 (43%) 属于 II 类医疗器械。
III 类医疗器械被 FDA 定义为高风险,通常被植入并用于维持生命,如果失败可能会导致严重的医疗并发症,包括死亡。例如心脏起搏器、深部脑刺激器、乳房植入物和心脏瓣膜。
欧盟如何对医疗器械进行分类?
欧洲医疗器械法规 (MDR) 附件八中有 22 条规则用于确定欧盟的医疗器械风险分类。设备可以被描述为属于与其基于风险的类别不同的四个类别之一:
1.无创医疗器械
2.侵入性医疗器械
3.有源医疗器械
4.特殊规则(包括避孕、消毒和放射诊断医疗器械)。
总之,欧盟的医疗器械进一步分为以下定义的基于风险的类别。
欧盟基于风险的医疗器械分类:
I 类设备被视为低风险或中风险设备,具体取决于设备是否无菌、具有测量功能还是可重复使用的手术器械。此类设备的示例可能包括听诊器、温度计或内窥镜。
IIa 类 设备被视为中等风险。此类设备的示例可能包括助听器或超声波设备。
IIb 类 设备被视为中/高风险。此类设备的示例可能包括输液泵、呼吸机或重症监护监测设备。
III 类 设备被视为高风险。此类设备的示例可能包括心脏起搏器、深部脑刺激器、乳房植入物和心脏瓣膜。
医疗器械风险分类对 FDA 和欧盟人为因素预期的影响
FDA 和欧洲法规并不排除制造商需要对某些基于风险的医疗器械类别实施人因工程流程。然而,在美国,大多数 I 类设备已在 FDA 注册,无需获得许可;因此,上市前提交不一定需要 HFE 文件。
在美国和欧盟,制造商不应仅参考医疗器械风险分类,而应评估与使用相关的风险,并根据使用相关风险分析 (URRA)。 也就是说,使用相关风险的数量受到设备复杂性和风险级别的影响。例如:虽然两者的误用都可能导致受伤或死亡,但手术刀可能只有 1-2 个使用步骤和一些潜在的使用错误,而透析机可能有数十个使用步骤和数百个潜在的错误。因此,证明手术刀安全使用的人因工程努力将比透析机少得多。
FDA 于 2022 年 12 月发布了指南,描述了根据设备的 HF 提交类别,营销提交中应包含哪些人为因素文档。 HF 提交类别是通过回答一系列问题来确定的,这些问题涉及设备是新的还是修改的、产品用户界面的更改、预期用户或使用环境以及基于 URRA 的关键任务的更改。值得注意的是,这些 HF 提交类别(1、2 和 3)与 FDA 的医疗风险器械分类系统(I、II 和 III)无关。然而,Emergo by UL 了解 FDA 医疗器械提交新人为因素指南的重要性以及如何应用该指南。
同样,在欧洲,医疗设备制造商预计将根据 FDA 概述的决策因素来扩大其人因工程工作。然而,IEC 62366-1 指南在详细说明所需的可用性文档方面并不像 FDA 的指南那么明确。
商通检测提供医疗器械FDA/CE认证、国内注册备案、检测以及咨询服务!










