FDA认证资讯 第2页
-
医用清洗器FDA认证从申请到获批流程
医用清洗器作为重要的医疗器械,在美国市场上市前必须通过FDA认证。该认证过程确保产品符合美国食品药品监督管理局的安全性和有效性标准,是产品进入美国市场的必要通行证。 一、医用清洗器FDA认证适用法规医用清洗器FDA认证主要依据以下法规:1. 联邦食品、药品和化妆品法案(FD&C Act) - 第510(k)章节的上市前通知要求 - 医疗器械分类管理规定2. 21 CFR Part 807 - 医疗器械...
-
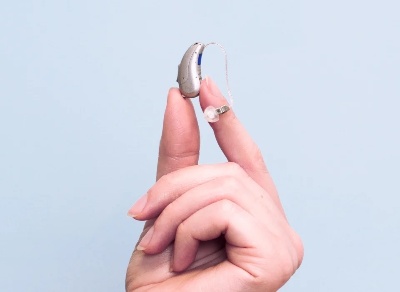
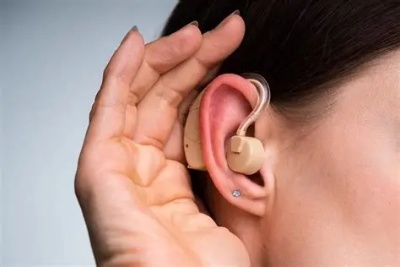
助听器FDA认证电磁兼容与生物相容性要求
助听器在美国属于医疗器械,必须通过FDA认证。电磁兼容性(EMC)和生物相容性是认证过程中的两个关键评估环节,直接影响产品的安全性和有效性认定。一、助听器FDA认证电磁兼容性(EMC)要求1. 发射测试要求辐射发射测试:30MHz-1GHz频段传导发射测试:150kHz-30MHz频段谐波电流发射测试电压波动和闪烁测试2. 抗扰度测试要求静电放电抗扰度:±4kV-±8kV射频电磁场抗扰度:3V/m-10V/m电快速瞬变脉冲群抗扰度:±1kV-±2kV浪涌抗扰度:±1kV-±2kV二、助听器...
-
助听器FDA认证技术文件要求与提交步骤解析
助听器在美国属于医疗器械,必须通过FDA认证才能上市销售。技术文件的准备和提交是认证过程中的关键环节,直接影响认证进度和结果。一、助听器FDA认证技术文件核心要求1. 产品技术规格 - 详细的产品描述和型号差异说明 - 电气参数和声学性能指标 - 结构组成和材料清单2. 设计与制造信息 - 设计验证和确认资料 - 生产工艺流程说明 - 关键工序控制...
-
助听器FDA认证中的临床评估与性能测试要求
助听器在美国被列为Ⅰ类或Ⅱ类医疗器械,必须通过FDA认证。临床评估和性能测试是认证过程中的核心环节,直接关系到产品的安全性和有效性评估结果。一、助听器FDA认证临床评估要求1. 临床数据收集真实环境使用数据用户满意度调查专业医师评估报告长期使用效果跟踪2. 有效性验证听力改善效果评估不同环境适应性测试用户使用习惯分析二、助听器FDA认证性能测试项目1. 电声性能测试最大声输出测试满档增益测试谐波失真测试等效输入噪声测试2. 安全性能测试电气安全测试电池安全测试电磁兼容测试生物相容性测试三、...
-
乳制品FDA检测标准与合规要素解析
乳制品出口美国必须符合FDA检测标准,这些标准涵盖微生物、化学污染物、营养成分和标签要求等多个方面。了解并满足这些要求是产品成功进入美国市场的关键。一、乳制品FDA检测适用范围与产品分类FDA对乳制品的监管覆盖所有品类:1. 液体乳制品:牛奶、奶油、发酵乳2. 固体乳制品:奶酪、奶粉、乳清蛋白3. 乳脂制品:黄油、奶油、冰淇淋4. 特殊乳制品:婴幼儿配方奶粉、医用乳制品二、乳制品FDA检测微生物检测标准1. 致病菌限量要求沙门氏菌:不得检出/25g李斯特菌:不得检出/25g大肠杆菌O157...
-
乳制品FDA标签要求及营养成分标注规范
乳制品出口美国必须符合FDA标签规定,确保产品标签准确反映产品特性并提供完整的营养信息。这些要求是产品进入美国市场的强制性条件。一、乳制品FDA适用范围FDA标签要求适用于所有在美国销售的乳制品,包括:1. 液体奶及奶油制品2. 奶酪和酸奶产品 3. 黄油及乳脂制品4. 冰淇淋和冷冻乳品5. 乳清蛋白和奶粉二、乳制品FDA强制标注内容1. 产品标识产品名称(通用常用名)净含量(英制和美制单位)生产商信息(名称和地址)2. 成分标注按重量降序列出所有成分标注主要过敏原(...
-
助听器FDA认证的关键步骤与流程
助听器在美国被列为Ⅰ类或Ⅱ类医疗器械,必须通过FDA认证才能在市场上销售。该认证确保产品符合美国食品药品监督管理局的安全性和有效性要求。一、助听器FDA认证产品分类与适用标准助听器FDA认证主要依据以下标准:1. 21 CFR 801.420:助听器特殊标签要求2. ANSI/ASA S3.22:助听器性能特性测量3. IEC 60118系列:电声性能测试标准4. 21 CFR 800:医疗器械通用要求二、助听器FDA认证关键认证步骤1. 产品分类确定根据风险等级确定产品类别选择适当的申报...
-
新鲜水果出口美国市场FDA认证攻略
新鲜水果出口美国需要通过FDA监管审核,确保符合美国食品安全标准。该过程涉及企业注册、产品合规和进口程序等多个环节。一、新鲜水果FDA认证适用范围与要求所有出口美国的新鲜水果都需要符合FDA规定,主要包括:1. 柑橘类:橙子、柠檬、葡萄柚2. 核果类:桃子、李子、樱桃3. 浆果类:草莓、蓝莓、树莓4. 热带水果:香蕉、芒果、菠萝5. 其他水果:苹果、葡萄、梨二、新鲜水果FDA认证核心合规要求1. 农药残留标准符合EPA制定的最大残留限量(MRLs)提供农药使用记录定期进行残留检测2. 微生...
-
新鲜水果FDA认证的核心要求与标准
新鲜水果出口美国需要通过FDA认证,确保产品符合美国食品安全标准。该认证重点关注农药残留、微生物污染和产品质量等方面。一、新鲜水果FDA认证适用范围所有进口到美国的新鲜水果都需要符合FDA要求,包括:1. 柑橘类水果:橙子、柠檬、葡萄柚2. 核果类水果:桃子、李子、樱桃3. 浆果类水果:草莓、蓝莓、覆盆子4. 热带水果:香蕉、芒果、菠萝5. 其他水果:苹果、葡萄、梨二、新鲜水果FDA认证核心认证要求1. 农药残留限制符合EPA制定的农药残留标准不得超过最大残留限量(MRLs)需要提供农药使...
-
乳制品FDA认证要求及申请步骤指南
乳制品出口美国必须通过FDA认证,确保产品符合美国联邦食品、药品和化妆品法案要求。该认证是乳制品进入美国市场的强制性准入条件。一、乳制品FDA认证适用范围所有出口美国的乳制品企业都需要进行FDA注册,包括:1. 牛奶及奶油生产商2. 奶酪和黄油制造商3. 酸奶及发酵乳制品企业4. 乳清蛋白和乳粉生产商5. 冰淇淋及其他冷冻乳制品企业二、乳制品FDA认证基本要求1. 企业资质要求具备有效的生产许可证通过HACCP体系认证建立食品安全防护计划2. 产品质量要求符合美国标准等级满足微生物限量标准...
-
乳制品出口美国FDA注册流程详解
乳制品出口美国必须完成FDA注册,确保产品符合美国联邦食品、药品和化妆品法案(FD&C Act)要求。该注册是产品进入美国市场的强制性准入条件。一、乳制品FDA注册适用范围所有出口美国的乳制品企业都需要进行FDA注册,包括:1. 牛奶及奶制品生产商2. 乳清蛋白生产企业 3. 奶酪和黄油制造商4. 婴幼儿配方乳粉工厂二、乳制品FDA注册基本要求1. 企业资质要求具备有效的营业执照获得生产许可证通过相关质量体系认证2. 产品标准要求符合FDA食品安全标准满足标签...
-
医药玻璃包装FDA认证特殊要求与审查要点
医药玻璃包装需通过FDA认证,证明其符合药品包装材料的严格标准。该认证重点关注材料的惰性、稳定性和安全性。一、医药玻璃包装FDA认证适用范围与法规依据1. 适用产品类型注射剂玻璃容器口服制剂玻璃瓶冻干剂型玻璃包装特殊药品玻璃容器2. 主要法规标准21 CFR第210-211部分USP<660>容器玻璃测试FDA指导文件容器 Closure Systems二、医药玻璃包装FDA认证材料特殊要求1. 化学成分要求硼硅酸盐玻璃组成碱性氧化物限量重金属含量限制2. 表面处理要求内表面处...
-
玻璃FDA认证从材料清单到成功注册流程
玻璃材料与食品接触需进行FDA合规性认证,证明其符合美国联邦法规第21章相关要求。该认证确保材料在使用过程中不会向食品迁移有害物质。一、玻璃FDA认证适用范围与法规依据1. 适用产品类型食品容器玻璃制品厨具玻璃器皿食品包装玻璃材料医药玻璃包装2. 主要法规标准21 CFR第174-190部分FDA CPG 7117.06/07ASTM C927-80测试标准二、玻璃FDA认证材料成分要求1. 基础材料规范二氧化硅含量要求碱性氧化物限制重金属迁移限量2. 添加剂管控着色剂使用限制澄清剂种类要...
-
脉搏血氧仪FDA认证流程详解与核心要点解析
脉搏血氧仪在美国属于Ⅱ类医疗器械,必须通过FDA 510(k)认证方可上市销售。该认证要求产品证明与已上市合法产品具有实质等效性,并符合相关性能和安全标准。一、脉搏血氧仪FDA认证产品分类与标准要求产品代码:DQA(脉搏血氧仪)分类:Ⅱ类医疗器械主要标准:ISO 80601-2-61:基本安全与性能要求ISO 80601-2-13:呼吸监护设备标准ISO 9919:脉搏血氧仪专用标准二、脉搏血氧仪FDA认证核心流程1. 确定对比产品选择1-2个已获得FDA许可的同类产品分析对比产品的技术特...
-
脉搏血氧仪FDA认证的关键步骤与合规路径
脉搏血氧仪在美国属于Ⅱ类医疗器械,必须通过FDA 510(k)认证方可上市。该认证要求产品证明与已上市合法产品具有实质等效性,并符合相关性能和安全标准。一、脉搏血氧仪FDA认证产品分类与标准要求产品代码:DQA(脉搏血氧仪)分类:Ⅱ类医疗器械主要标准:ISO 80601-2-61:基本安全与性能要求ISO 80601-2-13:呼吸监护设备标准ISO 9919:脉搏血氧仪专用标准二、脉搏血氧仪FDA认证核心步骤1. 确定对比产品选择1-2个已获得FDA许可的同类产品分析对比产品的技术特性和...