FDA认证资讯 第9页
-
激光手电筒FDA认证办理流程
激光手电筒属于“辐射电子产品”,在美国销售必须符合FDA的激光产品安全标准。通过FDA认证,产品才能合法进入美国市场,避免因不合规被海关扣留或罚款。 一、激光手电筒必须做FDA认证吗?是的! 根据美国《联邦食品、药品和化妆品法案》第21章,所有在美国市场销售的激光产品(包括激光手电筒)必须通过FDA认证(实际为FDA注册+激光产品报告)。 关键法规: - 21 CFR 1040.10(激光产品性能标准) - 21 CFR 1010(电子产品...
-
激光瞄准器FDA认证怎么做?
激光瞄准器属于激光产品,需符合美国FDA的《设备和放射健康中心》(CDRH)监管的21 CFR Part 1040法规。该法规规定了激光产品的性能标准和安全要求。 一、关键判断:您的产品属于哪类激光?1. Class I(≤0.39mW):免报备,但仍需合规标签 2. Class IIIa(1-5mW):民用瞄准器主流等级 3. Class IIIb/IV(>5mW):军用/警用,需特殊许可 ? 注意:市售激光瞄准器功率必须≤5...
-
激光瞄准器出口美国如何办理FDA认证?
激光瞄准器(Laser Sighting Devices)在美国受FDA下属的CDRH(器械与放射健康中心)严格监管,归类为激光产品(Class I-III)。 一、激光瞄准器FDA监管分类1. 适用法规: - 21 CFR 1040.10(激光产品性能标准) - 21 CFR 1010(电子产品辐射控制) 2. 风险等级: - Class...
-
暖奶器出口美国FDA认证如何办理?
暖奶器(Bottle Warmers)作为与食品接触的电器产品,出口美国需符合FDA(美国食品药品监督管理局)和联邦法规(21 CFR)的要求。 一、暖奶器FDA监管分类暖奶器通常归类为“食品接触设备”,需满足:1. 食品接触材料安全(21 CFR Part 175-178) 2. 电气安全(如适用FCC Part 15B,针对带电子元件的产品) 二、暖奶器FDA认证核心合规要求 1. 食品接触材料测试- 测试标准: ...
-
食品级胶水出口美国需要做什么认证?
食品级胶水出口美国,必须符合FDA 21 CFR 175.300(食品接触粘合剂标准),部分情况还需满足加州65号提案(有害物质限制)。 一、食品级胶水必须完成的认证 1. FDA食品接触材料认证 - 检测项目: - 总迁移量(≤10mg/dm²,模拟水、3%醋酸、50%酒精浸泡) - 特定迁移(铅≤0.01mg/...
-
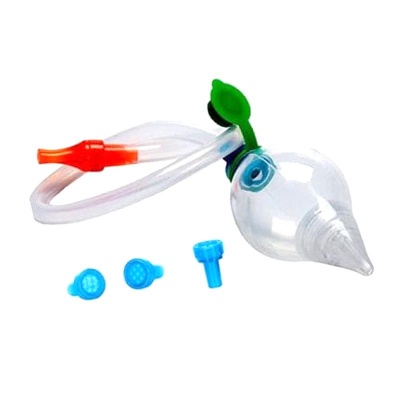
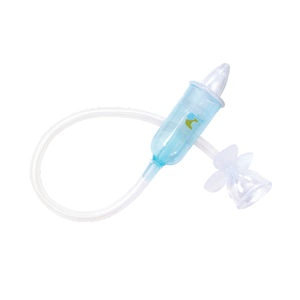
医用吸鼻器FDA认证是按照医疗器械做注册吗?
必须按照医疗器械注册!医用吸鼻器在美国FDA属于II类医疗器械(产品代码:FRH),需完成企业注册、产品列示和510(k)预市通知(电动款)。 一、如何判断医用吸鼻器FDA认证类别? 1. 手动吸鼻器 - 风险等级:Class I - 要求:仅需企业注册+产品列示,豁免510(k) - 法规依据:21 C...
-
医用吸鼻器出口美国需要做FDA认证吗?
一、医用吸鼻器必须办理FDA认证 医用吸鼻器作为II类医疗器械,出口美国必须完成FDA注册,并符合21 CFR 880.5860法规要求。未认证产品将被海关扣留,面临最高$1万美元/日的罚款。 二、医用吸鼻器FDA认证要求 1. 产品分类 - 手动吸鼻器:Class I(510(k)豁免) - 电动吸鼻器:...
-
凝胶出口美国需要做FDA认证吗?
凝胶产品的 FDA 认证不仅是进入美国市场的 “硬性门票”,更是企业证明产品安全性、合规性与市场竞争力的核心手段。无论从法规强制要求、消费者保护还是商业发展角度,通过 FDA 认证都是降低风险、提升品牌价值的必要举措。 一、凝胶产品的FDA分类及要求 1. 化妆品类凝胶(如面膜、保湿凝胶)- 监管要求: - 受FDA化妆品法规(21 CFR 700-740)监管,但无需FDA预先批准或注册。 - 需...
-
洁面仪上架美国亚马逊需要办理什么认证?
FDA认证的核心目的是确保产品的安全性。通过FDA认证的洁面仪能够证明其在使用过程中不会对人体造成伤害,符合美国的安全标准。这对于保护消费者健康至关重要,尤其是在涉及皮肤接触和可能的过敏反应方面。 一、洁面仪必须认证(所有洁面仪)1. FDA注册 - 普通洁面仪(仅清洁功能): - 按化妆品监管,需符合FDA 21 CFR 700-740(成分安全+标签规范),无需正式注册但建议做VCRP自愿备案...
-
洁面仪FDA认证办理流程
FDA认证是洁面仪进入美国市场的强制性要求。根据美国法规,洁面仪作为医疗器械(通常属于I类医疗器械)需要进行FDA注册。这不仅是为了满足法律要求,更是为了确保产品符合美国市场流通的标准。 一、洁面仪FDA认证监管分类洁面仪通常属于以下类别:1. 化妆品类(Cosmetic Device) - 仅用于清洁、美化皮肤(无医疗宣称),如普通洁面刷。 - 法规依据:FDA 21 CFR 第700-740部分(化妆品法规...
-
鸡肉香肠出口美国FDA认证如何办理?
要让鸡肉香肠顺利出口美国,必须完成FDA的合规程序。虽然FDA不直接颁发"认证",但企业必须完成注册、成分审查、标签合规等关键步骤。 一、鸡肉香肠FDA认证核心办理流程1. 企业FDA注册(强制)- 谁需要注册:所有生产、加工、包装或储存鸡肉香肠的企业(包括海外厂商)。 - 注册方式:通过FDA的FURLS系统在线提交。 - 关键要求: - 美国境外企业需指定美国代理(U.S. A...
-
调味料FDA认证流程与要求详解
虽然FDA不直接颁发"认证",但调味料进入美国市场必须完成强制性合规程序,包括企业注册、成分审查、标签合规等。一、调味料FDA认证核心流程(5大关键步骤)1. 企业FDA注册 - 谁需要注册:所有生产/加工/包装调味料的美国国内外企业。 - 如何注册:通过FDA的FURLS系统在线提交,获得唯一注册号(RN码)。 - 有效期:每...
-
调味料办理FDA食品认证指南
调味料(如辣椒粉、酱油、香料混合物等)出口美国需符合美国FDA(食品药品监督管理局)的监管要求。虽然FDA不颁发传统意义上的“认证”,但企业必须完成FDA注册、合规申报并遵循21 CFR法规。 一、FDA对调味料的分类与适用法规 1. 调味料在FDA的归类- 普通调味料(如盐、胡椒粉):属于“食品”类别,受《联邦食品、药品和化妆品法案》(FD&C Act)监管。 - 含添加剂/功能成分的调味料(如味精、防腐剂):需额外符合21 CFR Part 172(食品添加剂标...
-
制氧机出口美国需要做什么认证?
制氧机作为一种重要的医疗设备,在美国市场销售必须获得FDA认证。这是制氧机进入美国市场的“敲门砖”,没有该认证,制氧机无法进入美国市场,企业也就无法享受到美国市场的巨大红利。 一、制氧机核心认证清单 1. FDA认证(强制)- 分类:II类医疗器械(产品代码:FXX) - 法规依据: - 21 CFR 878.5650(医用气体设备) - 21 CFR 801(标签要求) - 认证...
-
制氧机出口美国是按照医疗器械做FDA认证吗?
是的,制氧机出口美国是按照医疗器械进行FDA认证的。具体来说,制氧机在美国FDA的医疗器械分类中属于II类非豁免510(k)的医疗器械。这意味着制氧机的风险等级适中,必须申请510(k)认证,才能获得市场准入许可。一、制氧机关键结论 属于医疗器械:制氧机在美国严格受FDA监管,需按医疗器械分类进行认证。 制氧机FDA认证分类决定路径: - 医用治疗型(如≥90%浓度):II类医疗器械(510(k)或PMA) &nbs...